Entwicklung und Zulassung von Impfstoffen
Wie alle Arzneimittel werden Impfstoffe gemäß aktueller behördlicher Richtlinien und gesetzlicher Anforderungen und unter Berücksichtigung wissenschaftlicher Leitlinien entwickelt, geprüft und zugelassen. Ziel ist die Bereitstellung eines qualitativ hochwertigen, wirksamen und vor allem sicheren Impfstoffs.
Entwicklung von Impfstoffen
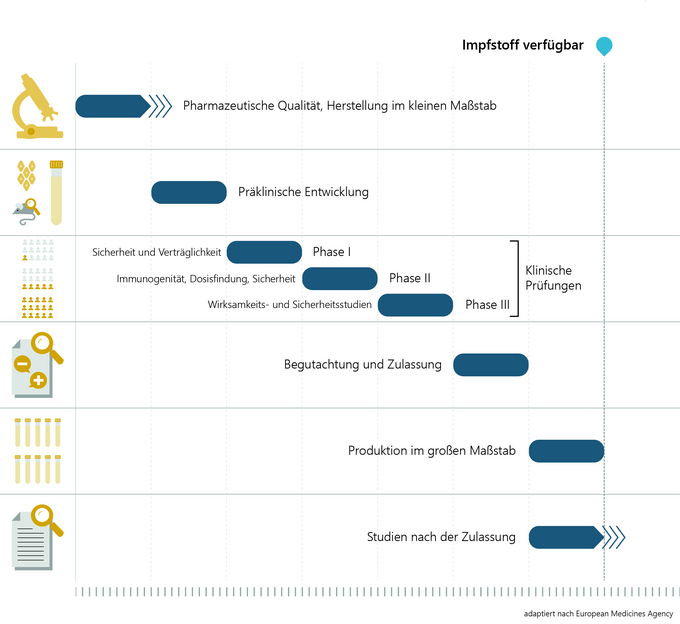
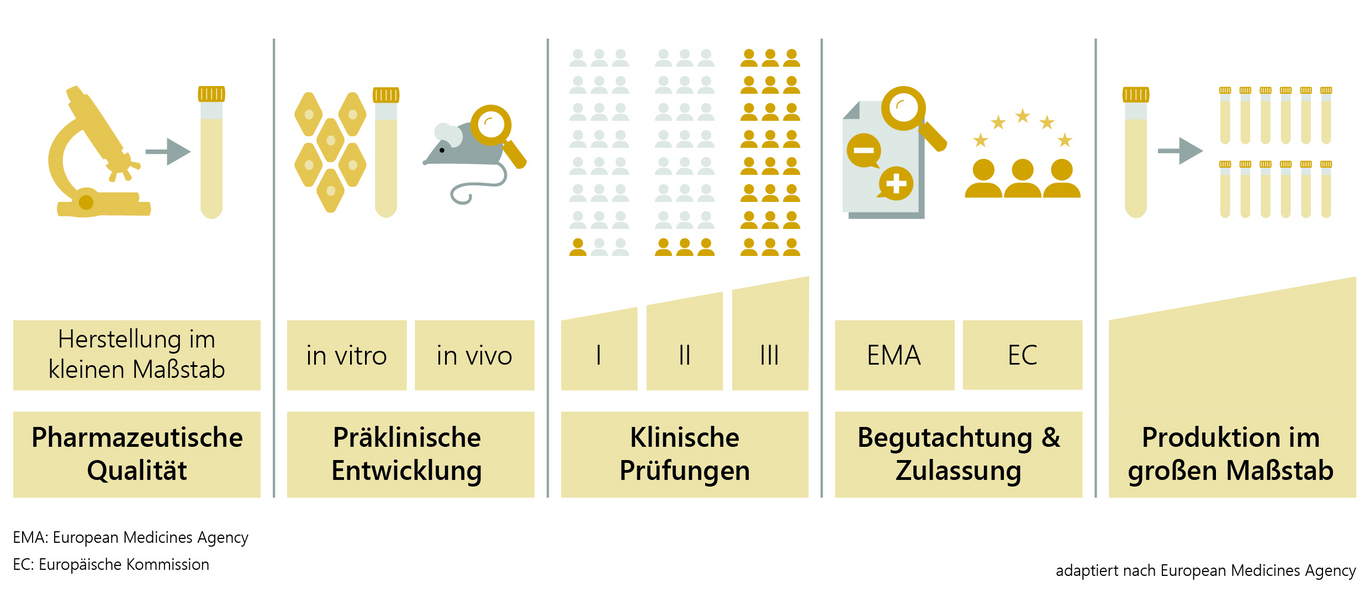
Die Entwicklung und Erforschung eines Impfstoffkandidaten im Labor dauert etwa zwei bis fünf Jahre. Zunächst wird der Krankheitserreger analysiert und geprüft, auf welche Bestandteile des Virus das Immunsystem des Menschen reagiert und einen Schutz (Antikörper) aufbauen kann. Danach folgen die Entwicklung des Impfstoffs und die Herstellung im kleinen Maßstab für die weitere Impfstoffprüfung an Tier und Mensch.
In der präklinischen Impfstoffentwicklung werden in Zellkulturen (in vitro, z.B. mit Immunzellen des Menschen) und in Tierversuchen (in vivo) Immunogenität (Fähigkeit des Antigens, eine Immunisierung auszulösen), Wirksamkeit und Sicherheit des Impfstoffs getestet. Erst nach umfangreichen Untersuchungen und dem Nachweis, dass der Impfstoff in guter Qualität und allen hohen Anforderungen entsprechend hergestellt werden kann, wird der Impfstoff in klinischen Prüfungen an freiwilligen und über alle eventuellen Risiken aufgeklärten Studienteilnehmerinnen und Studienteilnehmern erprobt. Auch das nimmt etwa zwei bis fünf Jahre in Anspruch.
Klinische Prüfungen
Die zuständigen nationalen Behörden und Ethikkommissionen stellen sicher, dass alle Studien wissenschaftlich gesichert und ethisch korrekt durchgeführt werden. Klinische Studien vor der Impfstoffzulassung lassen sich in drei Phasen einteilen.
Phase I: In der Regel sind zwischen 20 und 100 gesunde freiwillige Probandinnen und Probanden beteiligt, um anhand von Labortests zu prüfen, ob der Impfstoff die erwarteten Reaktionen auslöst (Immunogenität). In erster Linie wird hier aber die Sicherheit und Verträglichkeit getestet.
Phase II: Untersuchungen an mehreren hunderten freiwilligen Probandinnen und Probanden geben Aufschluss über die bestmögliche Impfstoffdosierung für einen optimalen Schutz, das Nebenwirkungsprofil und die Anzahl der benötigten Impfungen für ein bestmögliches Impfschema.
Phase III: In der letzten Phase wird der Impfstoff an einigen tausend (im Falle von COVID-19-Impfstoffen an mehreren 10.000) freiwilligen Probandinnen und Probanden in der Zielpopulation getestet. Sie zeigt, wie wirksam der Impfstoff im Vergleich zu einer Kontrollgruppe (z. B. Placebo) gegen die Erkrankung schützt und welche Nebenwirkungen mit welcher Häufigkeit gegebenenfalls auftreten können.
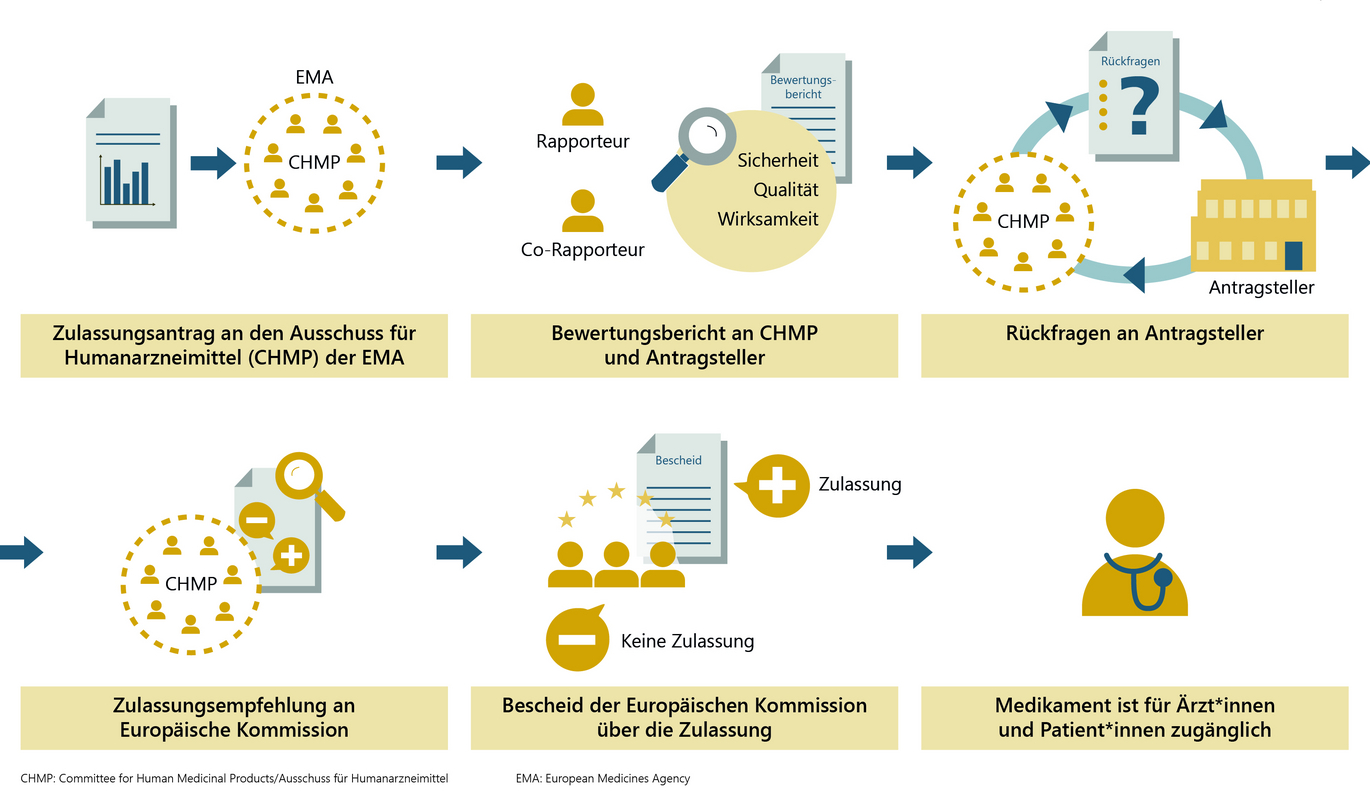
Ein behördliches Zulassungsverfahren ist grundsätzlich Voraussetzung dafür, dass ein Impfstoff auf den Markt kommt. Zulassung bedeutet: Prüfung eines Impfstoffs auf Qualität, Wirksamkeit und Sicherheit auf Basis der von der Antragstellerin oder vom Antragsteller vorgelegten Daten. In der EU wird das Zulassungsverfahren für COVID-19-Impfstoffe durch die Europäische Arzneimittelagentur (European Medicines Agency - EMA) koordiniert. Bei der fachlichen Begutachtung sind die nationalen Arzneimittelbehörden eingebunden.
Die Antragstellerin oder der Antragsteller reicht Zulassungsunterlagen nach klar vorgegebenen Richtlinien zur behördlichen Begutachtung ein. Diese beinhalten u.a. regulatorische Angaben, Daten zur Herstellung, präklinische und klinische Daten, aktuelle Fachliteratur sowie Informationen zur geplanten langfristigen Überwachung nach erfolgter Zulassung. Neben dem Impfstoffantigen, dem „eigentlichen Wirkstoff“, werden auch sämtliche anderen Inhaltsstoffe eines Impfstoffs bewertet. Das Europäische Arzneibuch, das Gesetzescharakter hat, definiert diese Inhaltsstoffe inklusive ihrer zulässigen Grenzwerte.
Ein Impfstoff wird dann zugelassen, wenn das vorliegende Nutzen-Risiko-Verhältnis positiv ist, somit der Nutzen die eventuellen Risiken überwiegt. Das „Standard“-Zulassungsverfahren selbst kann bis zu zwei Jahre dauern.
Erfüllt der Impfstoff alle wissenschaftlich-regulatorischen Voraussetzungen und überwiegt sein Nutzen gegenüber seinen Risiken, wird nach erfolgreichem Zulassungsverfahren vom Expertinnen- und Expertengremium der EMA (bestehend aus Vertreterinnen und Vertretern der EU-Mitgliedsländer sowie Norwegen und Island) eine Zulassungsempfehlung für den Impfstoff an die Europäische Kommission gegeben, die die Zulassung erteilt. Diese gilt für alle EU-Länder, eine nationale Zulassung ist nicht mehr erforderlich.
Zusätzlich ist in Österreich eine Chargenfreigabe durch ein behördlich ernanntes Arzneimittelkontrolllabor notwendig (OMCL – Offical Medicines Control Laboratory der AGES). Eine Charge ist eine im Zuge eines einheitlichen Herstellungsvorgangs produzierte Menge eines Impfstoffs. Jedes Arzneimittelkontrolllabor in der EU bzw. im Europäischen Wirtschaftsraum (EWR) und in der Schweiz kann, wenn es die gesetzlichen Anforderungen erfüllt, eine Chargenfreigabe für Impfstoffe durchführen. Die Freigabezertifikate müssen dann in der ganzen EU bzw. im ganzen EWR und in der Schweiz anerkannt werden. Die Herstellerinnen und Hersteller können selbst entscheiden, bei welchem Arzneimittelkontrolllabor sie ihren Impfstoff für eine Chargenfreigabe einreichen.
COVID-19-Impfstoffe
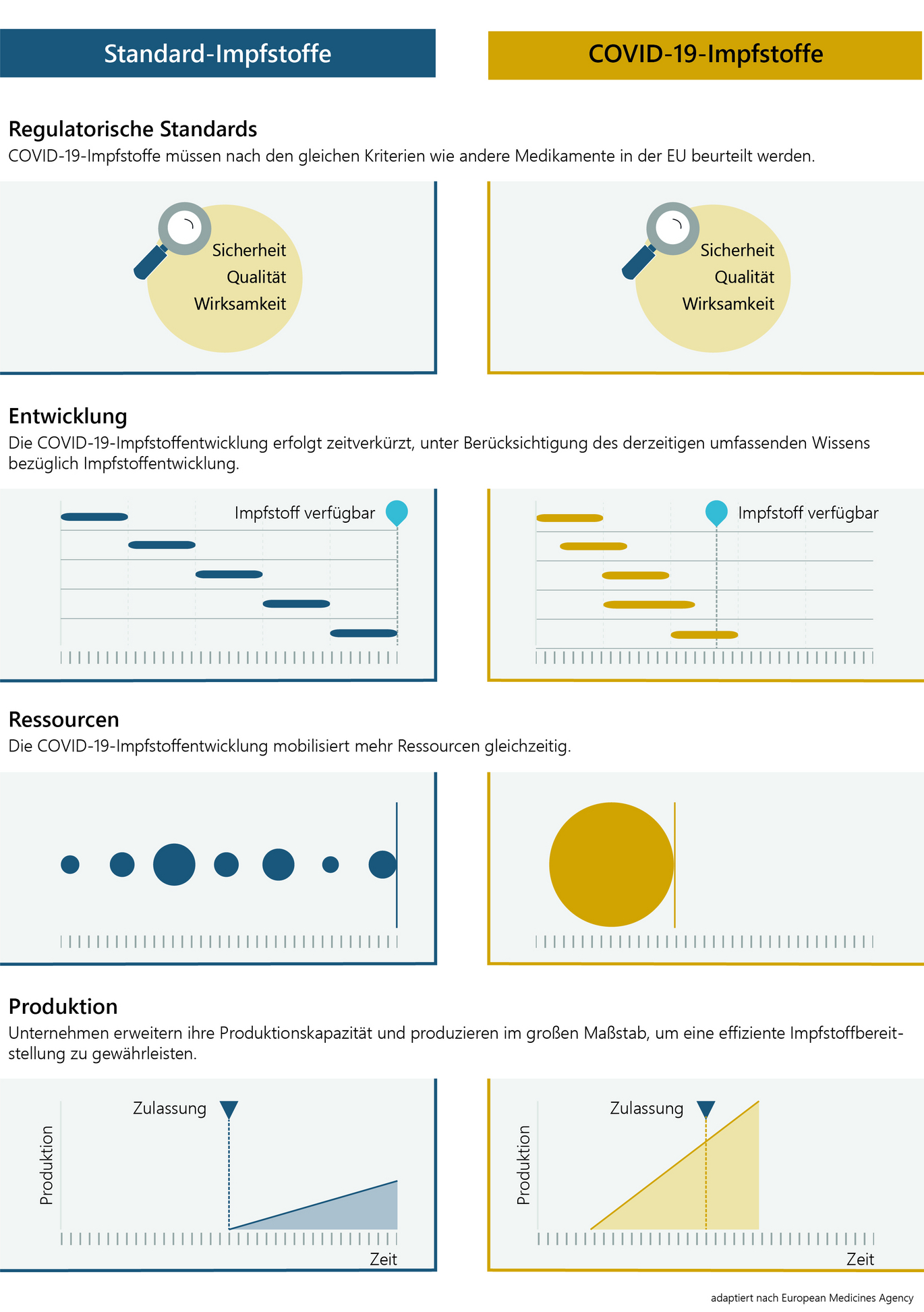
Die Entwicklung und der Zulassungsprozess von COVID-19-Impfstoffen verlaufen aufgrund der schwerwiegenden Folgen dieser Pandemie in beschleunigter Form. Dabei fließt umfassendes bereits vorhandenes Wissen über Coronaviren und Impfstoffentwicklung ein.
Um die Entwicklung zu beschleunigen, setzen Unternehmen und Forschungseinrichtungen wesentlich mehr Personal und finanzielle Ressourcen in kürzerer Zeit ein als bei herkömmlichen Entwicklungsprozessen. Wo dies unter Einhaltung der strengen Sicherheitsauflagen möglich ist, werden auch Studienphasen parallel durchgeführt. Darüber hinaus erweitern Herstellerinnen und Hersteller ihre Produktionsanlagen zu einem wesentlich früheren Zeitpunkt der Impfstoffentwicklung als üblich, damit nach Zulassung binnen kürzester Zeit rasch große Impfstoffmengen verfügbar sind.
Zusätzlich bietet die europäische Arzneimittelagentur (European Medicines Agency - EMA) eine beschleunigte wissenschaftliche Beratung für Impfstoffentwicklerinnen und Impfstoffentwickler an, um die Entwicklung zielgerichtet und fokussiert voranzutreiben.
mRNA-Impfstoffe
Einige Impfstoffe gegen COVID-19 werden unter Verwendung neuer Technologien entwickelt, von denen erwartet wird, dass sie die Mengen und die Geschwindigkeit der Produktion im Vergleich zu anderen Methoden der Impfstoff Herstellung erhöhen. Einer dieser neuen Ansätze basiert auf der sogenannten Messenger-RNA (mRNA). Dabei wird ein kleiner Teil des „Bauplans“ des Virus, der aus RNA (Ribonukleinsäure) besteht, im Labor hergestellt und dem Impfstoff hinzugefügt. Mit diesem Bauplan können Zellen des menschlichen Körpers einen Teil des Virus herstellen – ein sogenanntes Oberflächenprotein – das im Gegensatz zum Virus keine Infektion und daher auch keine daraus resultierende Covid-19 Erkrankung auslösen kann. Das Immunsystem erkennt dieses Oberflächenprotein als fremd und produziert Abwehrstoffe. Wenn sich eine geimpfte Person mit COVID-19 infiziert, ist das Immunsystem schon vorbereitet und kann den Krankheitserreger wesentlich besser bekämpfen. Die mRNA im Impfstoff wird in kurzer Zeit vom Körper wieder abgebaut, damit endet auch die Herstellung des Oberflächenproteins. Auf das menschliche Erbgut, das aus DNA besteht, kann die mRNA keinen Einfluss nehmen. Die beiden können sich nicht miteinander verbinden und darüber hinaus gelangt die mRNA nur in den Zellbereich außerhalb des Zellkerns, in dem sich die DNA befindet.
Beschleunigtes Zulassungsverfahren
Je eher ein sicherer und wirksamer COVID-19-Impfstoff verfügbar ist, desto rascher können mehr schwerwiegende Auswirkungen der aktuellen Pandemie verhindert werden. Die Vorteile eines Impfstoffs zum Schutz vor COVID-19 müssen aber weitaus größer sein als mögliche Risiken und Nebenwirkungen. Das Zulassungsverfahren stellt dies – auch bei beschleunigtem Ablauf – auf Basis unabhängiger wissenschaftlicher Bewertungen durch die Arzneimittelbehörde sicher. Darüber hinaus erfolgt eine engmaschige Überwachung auch nach der Impfstoffzulassung.
Bei den COVID-19-Impfstoffen gibt es in Qualität, Art und Umfang der behördlichen Begutachtung keine Abstriche und Unterschiede zum "herkömmlichen" Zulassungsprozess. Dieser wird jedoch mit den folgenden drei Maßnahmen zeitlich beschleunigt, um dringend benötigte Impfstoffe verfügbar zu machen.
1) Beschleunigtes Zulassungsverfahren
Der maximale Zeitrahmen für ein Standard-Zulassungsverfahren beträgt 210 Tage, an denen die Zulassungsbehörde aktiv an der Begutachtung der eingereichten Daten arbeitet. Beim beschleunigten Verfahren sind es maximal 150 Tage. Die Begutachtung verläuft in denselben Schritten und mit derselben Qualität, die Teams der Behörden setzen aber in kürzerer Zeit wesentlich mehr Ressourcen ein.
2) Rolling Review
Bei vielversprechenden Impfstoffkandidaten können die Zulassungsbehörden schon parallel zur laufenden Entwicklung beginnen, bereits vorhandene Datenpakete zu begutachten. Das nachfolgende "eigentliche Zulassungsverfahren" kann dann in kürzerer Zeit ablaufen, da große Teile der Daten bereits im Detail begutachtet wurden.
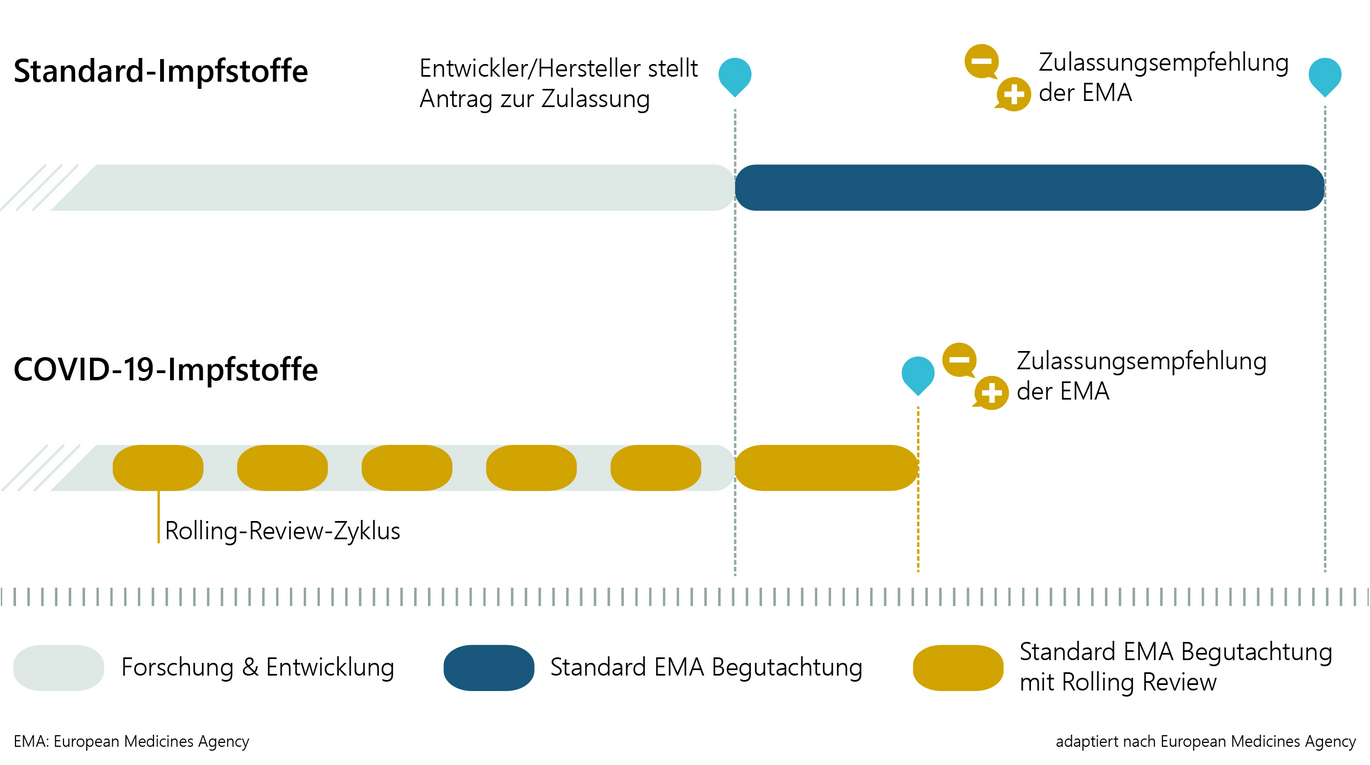
3) Bedingte Zulassung (Conditional Marketing Authorisation)
Diese Sonderform einer "ordentlichen Zulassung" kann nur gewählt werden, wenn es sich um Arzneimittel handelt, für die es aufgrund einer Notsituation einen dringenden Bedarf gibt, der aktuell nicht befriedigt werden kann - dies ist für die aktuelle Covid-19-Pandemie erfüllt. Die Antragstellerin oder der Antragsteller muss zunächst ausreichend Daten vorlegen, die Qualität, Sicherheit und Wirksamkeit des Impfstoffs belegen und eine Nutzen-Risiko-Bewertung ermöglichen. Bestimmte und zum Zeitpunkt der Zulassung genau zu definierende Daten und Informationen sind nach erfolgter Zulassung zur Begutachtung vorzulegen. Dies erfolgt mit strikten Auflagen und Vorgaben, zu welchen Zeitpunkten die noch ausstehenden Informationen an die Behörden übermittelt werden müssen.
Die bedingte Zulassung ist für ein Jahr gültig und kann bei Bedarf verlängert werden. Sobald alle Bedingungen und Auflagen erfüllt sind, kann die Bedingte Zulassung in eine "Standard"-Zulassung überführt werden.
Unabhängig davon, welche Möglichkeiten der Beschleunigung des Verfahrens eingesetzt werden, entscheidet die Nutzen-Risiko-Bewertung durch das Expertinnen- und Expertengremium der EMA, ob eine Zulassung empfohlen werden kann oder nicht. Kommt es zu einer positiven Bewertung und somit einer Empfehlung zur Zulassung, wird von der Europäischen Kommission der Zulassungsbescheid erstellt.
Impfstoffsicherheit nach der Zulassung
Impfstoffe werden nicht nur vor und während der Zulassung, sondern auch solange sie auf dem Markt sind, kontinuierlich überwacht. Unter Pharmakovigilanz wird dabei eine Vielzahl von Methoden und Aktivitäten verstanden, die es u.a. ermöglichen sollen, Nebenwirkungen zu detektieren, zu bewerten, zu verstehen und weiteren vorzubeugen.
Teil der Pharmakovigilanz ist die Meldepflicht von Angehörigen der Gesundheitsberufe im Zusammenhang mit der Anwendung von Impfstoffen. Sie besteht bei Humanarzneimitteln für vermutete Nebenwirkungen und auch für das Ausbleiben der erwarteten Wirksamkeit. Aber nicht nur Mitarbeiterinnen und Mitarbeiter im Gesundheitswesen, sondern auch Patientinnen und Patienten und deren Angehörige können vermutete Nebenwirkungen melden. Meldungen sind elektronisch oder schriftlich an das Bundesamt für Sicherheit im Gesundheitswesen (BASG) zu übermitteln.
Sämtliche Meldungen vermuteter Nebenwirkungen werden EU-weit gesammelt. Die Analyse all dieser Daten ermöglicht es, auf nationaler und europäischer Ebene ein mögliches neues Risiko zu erkennen (Signaldetektion), genau zu prüfen und damit zu mehr Arzneimittelsicherheit für alle Patientinnen und Patienten beizutragen. Wird ein Signal detektiert, wird dieses im europäischen Kontext im sogenannten PRAC (Pharmacovigilance Risk Assessment Committee) der EMA bewertet. Je nach Ergebnis der Bewertung werden Maßnahmen wie die Aufnahme von neuen Warnhinweisen in der Fach- bzw. Gebrauchsinformation oder im Extremfall sogar die Aufhebung der Zulassung eines Impfstoffs ergriffen.
Impfstoff Informationen des BASG
Weitere Informationen zu Arzneimitteln, Impfstoffen und Medizinprodukten finden Sie auf der Website des Bundesamts für Sicherheit im Gesundheitswesen (BASG).
Gebrauchs- und Fachinformationen der zugelassenen COVID-19-Impfstoffe finden Sie hier ebenfalls beim BASG.
Aktualisiert: 08.02.2024